注:如需PDF原文,请将E-mail发送至本公司邮箱,注明所需文章即可。
王修慧,罗新宇,杨娅,高宏,翟玉春
摘要:详细探讨了直接反应法制备异丙醇铝过程中单质碘对铝与异丙醇反应的催化机理,得出碘的催化作用在于:碘首先与铝反应生成AlI3 ,然后AlI3醇解生成异丙醇铝和HI,同时HI与铝反应又生成AlI3和H2。另外对铝与异丙醇的反应中碘的最佳用量以及铝—醇的最佳比例给出了明确的工艺参数。
关键词:催化机理;催化剂碘;异丙醇铝
异丙醇铝是一种重要的金属醇盐,大量应用于有机化工合成和高纯超细氧化铝粉体的研制中。铝醇盐的合成,最早出现在1881年,J. H. Gladstone和A. Tribe用碘为催化剂,使铝屑与乙醇反应制备出来了乙醇铝。限于当时的纯化学理论研究和科技发展水平,铝醇盐的合成进展缓慢。近几十年来,由于催化化学的发展,醇盐作为催化剂或制备高级氧化铝粉体的原料,得到了广泛应用。此外,随着溶胶凝胶技术的日益推广,作为溶胶凝胶法的主要前驱物金属醇盐的地位也越来越为人们所重视。采用金属醇盐为前驱物,利用溶胶凝胶法制得的氧化物粉体,由于具有高纯超细等优点而得到材料科学家的越来越多的青睐。
合成金属醇盐的方法有直接反应法和间接法。直接反应法就是金属与醇直接反应生成金属醇盐。碱金属、碱土金属及镧系元素等金属性很强的元素与醇可以发生剧烈反应(一般需要在保护气氛下进行)生成相应的金属醇盐;金属性稍弱的金属如Be、Mg、A1、Sc、Y及某些稀土元素则需在催化剂作用下才能与醇发生反应。在间接法中途径较多,如金属卤化物与醇的反应;金属卤化物与碱金属醇盐的反应;氧化物及氢氧化物与醇的反应;醇交换反应,酯交换反应及仲胺基化合物的醇解等。相比较而言直接反应法工艺简单,成本低,产物纯度较高,较容易实现工业化生产。
氯化汞是常用的制备金属醇盐的催化剂,使用碘作催化剂相对较少。氯化汞的催化机理已有报道,而碘的催化机理问题尚不太明确,有文献认为:碘可能起到清理金属表面或同金属形成了更容易同醇反应的碘化物。因此本文针对碘催化合成异丙醇铝的催化机理做了较具体的探讨。
1 材料与方法
采用金属铝与异丙醇直接反应法制备异丙醇铝。以铝屑(纯度> 99. 99%)和异丙醇(分析纯)为原料,在I2或HgCl2 (分析纯)催化条件下,经加热、回流,蒸发溶剂后制得铝的异丙醇盐。
合成异丙醇铝的有两种常见催化剂HgCl2和I2,为了选择催化剂,考查催化剂的催化效果,本文做了平行对比实验,即保证金属铝的量为6. 75 g,异丙醇的量为150mL,两种催化剂在异丙醇中的浓度不变的情况下,考查两种催化剂对反应时间的影响。
为了确定工艺参数,在反应体系中碘的量用I2与HOPri之质量体积比表示[mg/mL ],以及金属铝和醇的质量体积比表示醇的加入量,做如下实验:首先取铝和醇的量分别为13. 5 g和200 mL采用不同加入量的碘,考查不同浓度的碘对反应时间的影响;然后取铝和碘浓度分别为13. 5 g和1. 5 mg/mL采用不同量的异丙醇,考查不同量的醇对反应时间的影响。
2 结果与讨论
2. 1催化剂的催化效果对比
图1是两种催化剂之催化效果的对比图。从图中可以看出两种催化剂的催化效果是截然不同的。在I2催化合成反应中,随着I2加入量的增加完全反应时间逐渐减少,而且当碘浓度大于1.5mg/mL后反应时间迅速缩短;在HgCl2催化合成反应中,随着HgCl2加入量的增加完全反应时间反而逐渐增加。虽然氯化汞浓度对反应速度也产生影响,但即使使用量达到最佳值,完全反应时间也需要5h左右。
铝屑与异丙醇的基本反应方程式为:
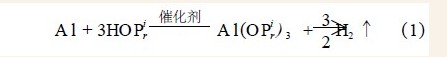
出现催化效果不同的根本原因在于他们的催化机理的不同。有人对HgC12的作用机理进行过详细的讨论:由于Hg2+氧化电位高于Al3+使汞易被铝置换出来。

被铝置换出来的汞很容易与铝形成组成不定的铝汞齐,即在金属铝表面形成催化活性中心,从而提高了Al的反应活性,铝表面活性中心数目越多越有利于该合成反应的进行。但当HgCl2加入量增加时,被置换出来的汞会包裹在铝的表面,从而减少了铝与醇的接触面积,造成反应速度的降低。
2. 2 碘催化机理分析
文献报导:碘催化合成金属醇盐是碘与金属形成了中间体——碘化衍生物,使金属容易与醇发生反应,但这种说法还不够具体。
在铝与醇的整个反应体系中,醇起着相当于酸的作用,由于醇是比水还要弱得多的酸,所以铝与醇直接反应是困难而缓慢的。
当用碘作催化剂时,整个体系并不复杂,只有铝、醇和碘存在。根据化学反应原理,整个体系中极有可能存在如下的一系列化学反应:

反应起始通过反应(3)碘与铝作用生成AlI3,此种化合物中由于Al3 +具有很强的极化作用和I- 具有很强的变形作用而形成典型的共价性卤化物,它在水中会发生较强烈的水解,生成Al(OH)3和H I,相应的在具有极性的醇中也会发生醇解作用,生成Al (OPri ) 3或Al (OPri ) x I3 - x和H I,如反应(4)和(5)。反应生成的H I会与金属铝反应生成AlI3,从而形成循环反应,金属铝和醇不断被消耗,生成AlI3和醇解后的铝醇盐。当碘单质被完全反应时,生成的AlI3达到最高浓度,表现在反应现象上是醇溶液变为由碘色变为无色,且反应达到最剧烈程度。反应完毕后将溶液静置冷却,会看到溶液的颜色由无色渐变为碘色,说明有碘被氧化为单质,这可能是由于体系中的少量HI发生了分解反应(7)。
另外铝醇盐还具有自催化性,这是由于三价铝离子的空轨道与醇羟基的氧的孤对电子形成配位键,导致羟基上的电子云更加偏移向氧原子,使羟基上的氢更容易发生电离,溶液的酸性增强,即反应(8);随醇解反应的进行AlI3浓度不断降低,Al (OPri ) 3或Al (OPri ) x I3 - x浓度增加,剩余铝金属的反应主要由反应(8) 、(9)控制。

2. 3 碘最佳浓度及铝—醇比例的确定
图2是不同浓度的碘对异丙醇铝合成反应的影响曲线。从图中可看出碘浓度越高反应越快,若以8h为反应完成可接受的时间界限,则I2在催化合成异丙醇铝的最低浓度为1. 3 mg/mL;在碘浓度大于2mg/mL以后,虽然反应时间大大减少,甚至小于1 h,但这却增加了副产物的量,对异丙醇铝前驱物的纯度有影响。
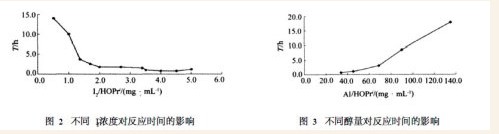
图3是不同量的醇对合成反应速度的影响曲线。由图可知当其它条件固定时,醇量越多对反应越有利,Al/HOPri应小于100 mg/mL;若大于此值则金属铝完全反应时间过长甚至合成反应不能完成。这是由于若醇量过少,则随着反应的进行反应液中醇的浓度逐渐降低,导致与铝接触的几率变小,而使完全反应时间变长。
3 结 语
碘催化合成异丙醇铝过程中,是由于碘的氧化性与铝形成了中间产物化合物AlI3及其醇解后的铝醇盐的自催化共同作用的结果;若以8 h为反应完成可接受的时间界限,则I2在催化合成异丙醇铝的最低浓度为1. 3mg/mL,铝和醇的质量体积比(mg/mL)不能超过100 ∶1。
|


